化学専攻 教授 三木 邦夫

これまでのおよそ40年間、結晶学を手法とする構造生物学の研究に携わってきた。私がこの研究分野に入った頃は、タンパク質の結晶構造解析には極めて長い時間を要した。一つのタンパク質の結晶構造の決定に数年以上かかっても、ああそんなものだろうと皆が思う時代だった。
1982〜83年、ミュンヘンのマックスプランク生化学研究所で、光合成のエネルギー変換を行う反応中心複合体の結晶構造研究の一端を担う機会を得た。これは初めて結晶解析に成功した膜タンパク質の構造で、私としても多くの貴重な経験を得た。難しい構造解析であったが、当時としては比較的短い期間で構造決定ができ、共同研究者たちは1988年のノーベル化学賞を受賞した。1990年台に入ると、結晶化に必要なタンパク質試料が遺伝子工学の技術で大量調製できるようになり、また、極めて強いX線強度が得られ、かつ波長を自由に選択できるシンクロトロン放射光が汎用的に使えるようになり、タンパク質の結晶構造解析は飛躍的な進展を遂げた。タンパク質データバンク(PDB)に登録されたタンパク質構造の数は、1990年には500程度しかなかったものが急激な増加を見せ、現在では12万にも迫ろうとしている。今世紀に入ると、全タンパク質の三次元構造を知ろうとする構造ゲノム科学が世界的な潮流になり、我が国でも国家プロジェクトが推進された結果、タンパク質結晶学は研究手法として迅速化、汎用化が進み、その後さらに成熟した高度な技術に発展していった。
そのような状況で、膜タンパク質の構造解析も着実な進歩をみせた(図1)。また、構造解析技術の高度化は、タンパク質の超高分解能構造解析という新しい可能性を生み出した。これまでは1.5〜3Å分解能で構造解析されるのが通常で、タンパク質のフォールディングや活性部位の構造が明らかにされてきたが、さらに1Åを超える分解能での構造解析も可能になったことで、それまでは難しいと考えられていた水素原子の位置や外核電子(価電子)の情報まで得られる場合もでている(図2)。分子がきれいに並ぶ結晶に魅力を感じたという単純な動機でこの分野の研究を始めたが、研究方法として大きく飛躍する時代を経験でき、また、この方法の今後の新しい可能性を直接確認できたことは幸運であったと感じている。
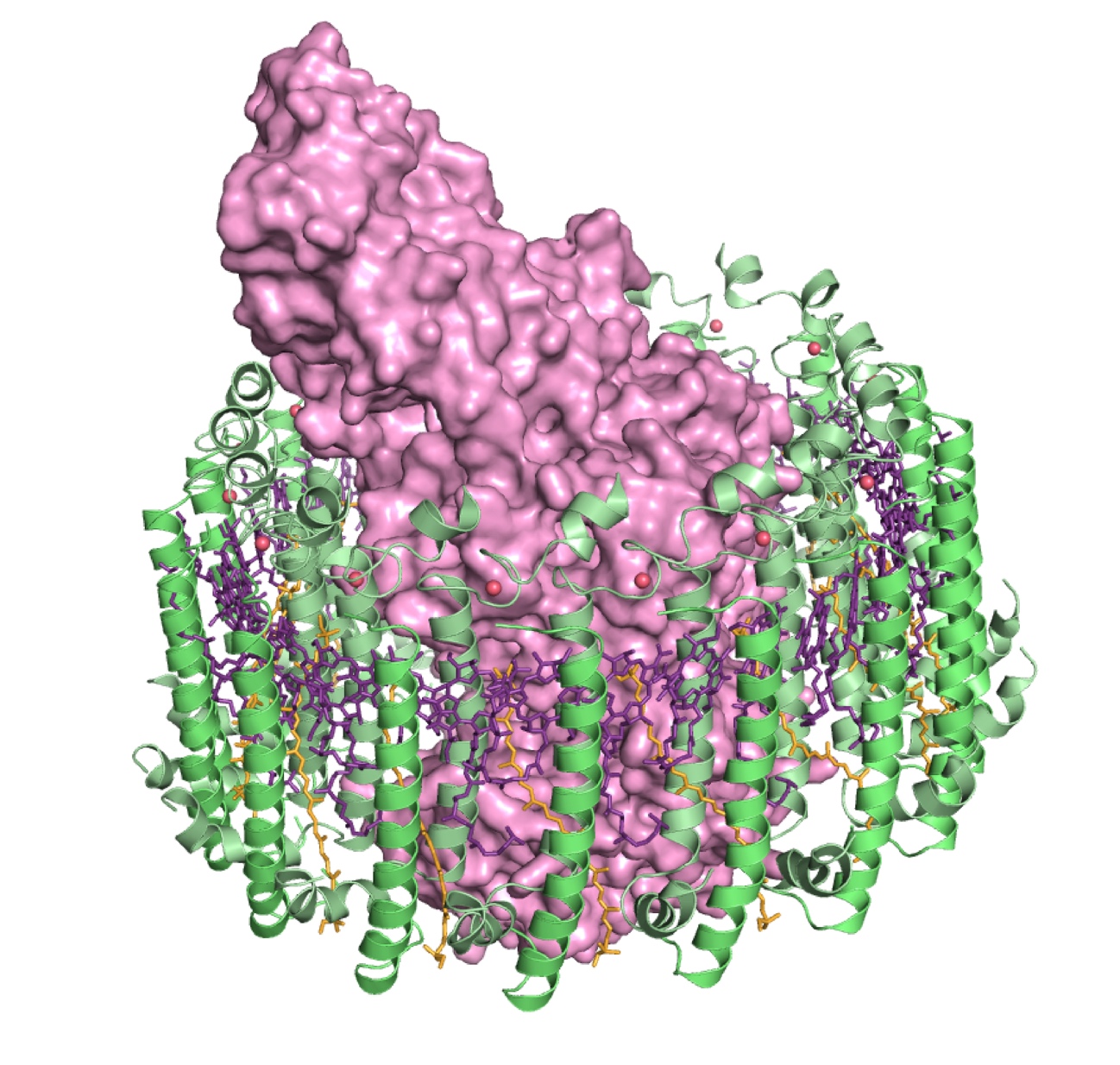
図1.光合成反応中心と集光アンテナタンパク質の複合体構造(S. Niwa et al., Nature, 2014)。茨城大学大友征宇博士のグループとの共同研究。1985年に膜タンパク質として初めて構造が決定された光合成細菌の反応中心は、30年後にそれに光エネルギーを供給するアンテナタンパク質(LH1)との複合体状態での結晶構造が解明された。反応中心は分子表面モデル(マゼンタ)、アンテナタンパク質はリボンモデル(緑色)、その色素(バクテリオクロロフィル)は棒状モデル(紫)で示している。
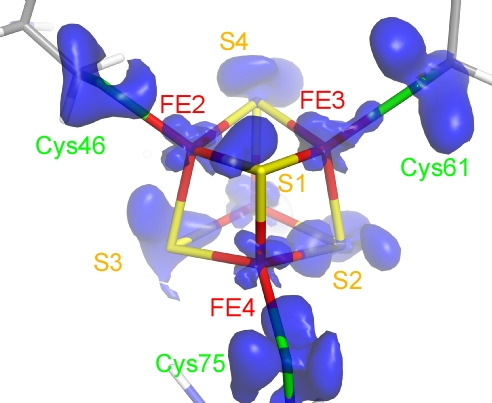
図2.光合成電子伝達タンパク質、HiPIP(高電位鉄イオウタンパク質)の0.48Å 分解能での結晶構造におけるFe4S4クラスターの外殻電子密度(Y. Hirano et al., Nature, 2016)。Fe4S4クラスター(鉄が赤、イオウが黄色の棒状モデル)はタンパク質の4つのシステイン残基に共有結合している。電荷密度解析で観測された電子密度は青色の表面プロットで描画(鉄周りの3d電子およびイオウ周りの3p電子に対応)。



